臓器移植を必要とする患者の数は年々増加しており、臓器不足の根本的解決策として、ブタの臓器を用いる異種移植が本格的に検討され始めたのは1990年代からである。私は、これまでに人獣共通感染症講座(85、100、124回)、本連載(1、2回)と、著書や訳書(1,2)で異種移植の進展を紹介してきた。2000年代から異種移植の研究は着実に進展しはじめ、2013年に発表された遺伝子編集という革新的技術により実用化にさらに近づいてきている。これまでの経緯を簡単に振り返り、現在の状況を紹介する。
1960年代から人とサルにはブタの臓器に対する抗体が存在していることが知られていた。1991年第1回国際異種移植学会で、この抗体が標的にしている物質は、α1,3 ガラクトース(αガラクトース)ということが発表された。哺乳動物のうち、人とサルではαガラクトース抗原に対する自然抗体が存在している。ブタの臓器がヒトやサルに移植されると、この抗体が結合し、ひきつづいて一連の補体の反応がおきて、ブタ臓器は数分以内に拒絶される。この超急性拒絶反応を回避するために、補体制御蛋白のひとつであるDAF(decay accelerating factor)の遺伝子を導入したトランスジェニック・ブタが1992年にイムトラン社で作出された。1995年、このブタの心臓は、ヒヒの腹腔に移植したところ、60日以上生着していた。超急性拒絶反応は回避されていたのである。製薬企業ノバルティス社は、イムトラン社を買収し、1996年に異種移植用ブタの開発研究に10億ドルを投資する計画を立てた。同時にボストンのジェンザイム社と英国のPPL社(クローン羊ドリーを作出した研究所)も開発競争に参入した。
移植用ブタでは拒絶反応の回避の問題とともに、ブタ由来のウイルスの問題がきわめて重要とみなされた。ノバルティス社はブタ由来ウイルスに対する安全確保のための国際委員会を設置し私も委員として参加して3年間にわたって検討を行った。その中でとくに重要視されたのはブタ内在性レトロウイルス(porcine endogenous retrovirus: PERV)である。ほとんどのウイルスは除去できるが、PERVはすべてのブタの染色体に組み込まれているため、これを除去する技術はなかったためである。
一方、1997年に発表されたクローン羊ドリーを作出した体細胞核移植は、DAF導入ブタに応用され、2000年代初めには、いくつかのチームがα1,3ガラクトシルトランスフェラーゼ(αガラクトースを産生する酵素)をコードする遺伝子を破壊したノックアウト・ブタを作出した。
しかし、PERVを除去する見通しはなかった。2000年代初めにノバルティス社は異種移植の事業から撤退した。一方、PPL社の延長として設立されたRevivicor社(現在はUnited Therapeuticsの子会社)は、ノックアウト・ブタにさらにヒトCD46(補体制御タンパク質)とトロンボモジュリン(血小板凝固を抑制するタンパク質)をそれぞれコードする遺伝子を導入した。このブタの心臓は、ヒヒの心臓のそばに移植して945日間、生着した。ほかの企業では、ヒヒの腎臓をほぼ同様の遺伝子改変を行ったブタの腎臓に置き換えて(生命維持の条件で)136日間生着させることに成功した(3)。
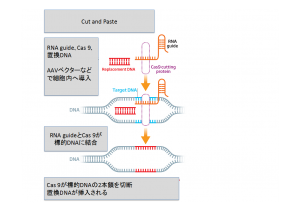
拒絶回避の技術は進展したが、PERVは数多くの部位に組み込まれているため、その遺伝子をひとつずつノックアウトすることは不可能に近いと思われていた。ところが、2012年に発表されたCRISPR/Cas 9(クリスパー・キャスナイン)によるゲノム編集技術により複数の遺伝子を同時に改変することが可能となった。クリスパー(Clustered Regularly Interspaced Short Palindromic Repeat:CRISPR)とは、等間隔にスペーサーが入った短い回文構造の反復配列のクラスターを指すもので、キャスナイン(Cas 9)はクリスパーの反復配列の近くに存在する遺伝子群がコードするCas(CRISPR associated)蛋白のひとつで、DNAを切断する働きを示す。図に示すように、切断する標的塩基配列を含むガイドRNA、キャスナイン、および置換DNAを細胞内に導入すると、RNAガイドとキャスナインが標的DNAに結合し、キャスナインが標的DNAの2本鎖を切断する。そこに置換DNAが、細胞固有のDNA修復機構により組み込まれるのである。これはパソコンでのCut & Pasteによる編集にたとえられる。
ハーバード大学のLuhan Yangたちは、ブタの継代細胞PK15でクリスパー・キャスナイン技術によりPERVを一括して除去することを試みた。まずPERVが細胞内に62コピー含まれていることを確認し、これらのPERVのpol遺伝子の間で高度に保存された領域を標的とする2種類のキャスナイン・ガイドRNAをデザインした。pol遺伝子の産物は逆転写酵素として働くので、pol遺伝子を破壊することでPERVの複製と感染を阻止できる。こうして、ブタのゲノム内のすべてのPERVのpol 遺伝子を破壊したPK15細胞をヒト細胞と一緒に培養した結果、PERVの感染はほとんど検出されなくなった。この実験は継代細胞で行ったものだが、ブタの体細胞で同様の方法でPERVのpol遺伝子を破壊したのち、体細胞核移植を行うことでPERVフリーのブタを作出する見通しが出てきた(4)。
文献
1.山内一也:異種移植.河出書房新社、1999.
2.デイヴィッド・クーパー、ロバート・ランザ(山内一也訳):異種移植とは何か.岩波書店、2001.
3.Perkel, J.M.: Xenotransplantation makes a comeback. Nature Biotec., 34, 3-4, 2016.
4. Yang,L., Güell, M., Niu,D. et al.: Genome-wide inactivation of porcine endogenous retroviruses (PERVs). Science, 350, 1101-1103, 2016.