オミクロン株は、急速に広がり社会活動に大きな影響を与えている。オミクロン株では潜伏期がデルタ株の約5日に対して約3日と短く、症状は主に鼻や喉といった上気道に限られる。従来のウイルス株の場合に問題になった味覚や嗅覚の異常はみられない。重症化のリスクは従来のウイルス株よりも低い。このようなオミクロン株感染の症状や伝播状況といった臨床疫学的知見について、大量の情報がメディアなどを通じて発信されているが、ウイルス学の立場から見たオミクロン株の特徴については、専門的な内容になるためか、検索した限り、ほとんど見当たらない。従来のウイルス株と異なる、オミクロン株のウイルス学的性状について、これまでに報告されている主な知見をまとめてみる。
ウイルスの細胞内への侵入経路が異なる
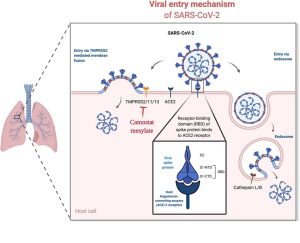
コロナウイルスの細胞への感染は、ウイルスのスパイクタンパク質の受容体結合ドメイン(RBD)が、細胞膜に存在するウイルス受容体であるACE2と呼ばれるタンパク質に結合することから始まる。次いで、ウイルスが細胞内侵入するのだが、それには、図1に示したように、細胞融合を介する経路とエンドソームを介する経路の2通りがある。前者では、ウイルスは細胞に結合したのち、細胞膜に存在するTMPRSS2と呼ばれるタンパク質分解酵素で切断され、細胞膜に融合することにより、細胞内に侵入する。もうひとつの経路では、細胞に結合したウイルスは細胞膜に包まれて細胞内に飲み込まれ(エンドサイトーシスと呼ばれる現象)、エンドソームと呼ばれる小胞を形成する。そして、エンドソームに存在するタンパク質分解酵素のひとつ、カテプシンでスパイクタンパク質が切られて細胞質内に侵入する。
新型コロナウイルスは、武漢株を初め、デルタ株などの変異株のいずれも、細胞融合の経路で侵入する。ところが、オミクロン株は違っていて、エンドソームの経路を取っている。しかし、重症急性呼吸器症候群(SARS)ウイルスもエンドソーム経由であり、この侵入経路の違いがオミクロン株の病原性の低下に直接関係しているとは考えにくい(1, 2)。
ウイルスの増殖性は気管では高く肺では低い
外科手術などで採取した健康人の気管組織片または肺の組織片を培養し、それらでのオミクロン株とデルタ株の増殖を24時間、48時間、72時間の3つの時点で比較してみたところ、気管組織片では、24時間と48時間でのウイルス量が、オミクロン株ではデルタ株の70倍以上に増えていた。しかし、72時間になるとオミクロン株とデルタ株の間で差はなくなった。一方、肺の組織片の培養では、オミクロン株の増殖性はデルタ株よりも低かった(3)。
ヒトの鼻の上皮細胞の3次元培養*では、オミクロン株は、デルタ株とほぼ同じ程度に増殖した。一方、ヒト肺のオルガノイド*やヒト肺上皮腺がん細胞ではデルタ株よりも増殖性が低下していた(1)。ハムスターとマウスでの動物実験でも、オミクロン株の場合、肺の中のウイルス量が気管の10分の1以下と低いことが報告されている(4, 5)。
注
3次元培養:普通の細胞培養は2次元培養で、プレートの上で横に広がる。3次元培養では、細胞が縦方向にも増えるように作製された培養装置を用いる。
オルガノイド:ES細胞、iPS細胞、組織の幹細胞などから分化させた実物に近い構造を持つミニ臓器。
融合活性の減少
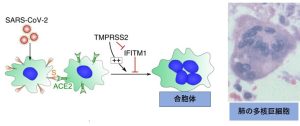
コロナウイルスは、スパイクタンパク質を介して細胞融合で侵入するだけでなく、図2に示したように、隣り合った細胞との融合も引き起こす。これにより大きな細胞質で多数の核を持つシンシチウム(合胞体;別名、多核巨細胞)と呼ばれる細胞が形成される。その結果としてウイルスは次々に周囲に拡がる。合胞体はデルタ株など従来株の患者の肺で見られる。
培養細胞での実験で、デルタ株では合胞体の形成がアルファ株やベータ株よりも促進されている。しかし、オミクロン株では、合胞体の形成がほとんど見られない(1)。融合活性の低下は症状が軽いことに関連していると推測されている。既存の薬を治療薬に利用する研究では、合胞体の形成を阻止する活性のある薬の探索が行われている(6)。
唾液へのウイルス排出が多い
南アフリカのケープタウン大学のチームが、同じ人から鼻粘膜の拭い液と口腔粘膜の拭い液を採取してPCR検査を行ったところ、デルタ株では鼻の拭い液がすべて陽性になった場合に、口腔の拭い液では70%が陽性だった。オミクロン株の場合は逆で、口腔の拭い液がすべて陽性の際に鼻の拭い液では86%が陽性だった。この結果からオミクロン株では唾液の方にウイルスがより多く排出されていると推測された。また、検査には唾液の方が妥当と考えられた(7)。
キラーT細胞の標的となるT細胞エピトープはほとんど変異していない
オミクロン株では53箇所にアミノ酸変異があり、そのうち37箇所はスパイクタンパク質に起きている。スパイクタンパク質の変異のうち、15箇所は中和抗体の主な標的となる受容体結合ドメイン(RBD)に存在する。そのため、過去の感染やワクチンで産生された抗体による中和活性が低下している。
一方、ウイルス感染細胞を破壊する重要な防御システムの担い手としてのキラーT細胞の標的は、ウイルス感染細胞の表面に出現するT細胞抗原決定基(エピトープ)で、これは通常5-8個のアミノ酸がつながったペプチドである(本連載133)。コンピューター解析ではオミクロン株のスパイクタンパク質には推定200箇所以上のT細胞エピトープが存在していて、そのうち80%以上は変異していなかった。この結果から、キラーT細胞の機能はしっかり保たれていると考えられる(8, 9)。
mRNAワクチン(ファイザーやモデルナ)はキラーT細胞の産生を誘導しているため、抗体が変異のために感染を防げなくても、キラーT細胞が重症化を防ぐのに役立っていると考えられる。不活化ワクチン(中国のシノバックなど)ではキラーT細胞は産生されない。
ウイルス遺伝子のプロフィール
WHOが「懸念される変異株」と指定したベータ(2020年9月)、ガンマ(2020年12月)、デルタ(2020年12月)、オミクロン(2021年11月)という4つの変異株が約16ヶ月の間に出現している。このような大きな進化が短期間に起きたことは、これまで見られたことがない。現代社会での人の行動や、ワクチン、治療薬などによる影響など、さまざまな要因がウイルスの変異を促進していると考えられる。
南アフリカを中心とした米、英、ブラジルなどの合同チームは2021年12月初めまでに得られた686個のオミクロン株ゲノムを解析した結果、オミクロン株はアルファ株の属するB.1.1系列に属するが、アルファ株など既知の変異ウイルス株とはかなり異なることが明らかにされた。
系統樹を経時的に解析した結果、オミクロン株の直近の祖先ウイルスは2021年10月初めに出現したと推定された。そして、既存の抗体から免れることで高い伝播性を示すウイルスが選択され、適応進化により、オミクロン株が生まれたと考えられている(10)。
オミクロン株の起源
オミクロン株の起源については、3つの可能性が考えられている。ひとつは、単に見逃していたというものである。これまでに数百万個のゲノムがデータベースに登録されているが、大部分はまだ解析されていない。その中にオミクロン株につながる変異を示す配列があるかも知れないというわけである。2番目の可能性は免疫不全などで長期間感染が続いていた人の体内で変異が繰り返されて生まれたというものである。5ヶ月間持続感染したのち死亡した例では、1 mlあたり1000万コピーという高濃度のウイルスが検出され、スパイクタンパク質遺伝子にアミノ酸変異が見いだされていた。3番目は、動物宿主の体内で人から感染したウイルスが変異したという可能性である。新型コロナウイルスはネコ、ミンク、野生のシカなど、さまざまな動物に感染し、そこで生まれた変異ウイルスが人に逆戻りしたというわけである(11)。
文献
- Meng, B., Ferreira, I.A.T.M., Abullani, A. et al. : SARS-CoV-2 Omicron spike mediated immune escape and tropism shift. bioRxiv preprint doi: https://doi.org/10.1101/2021.12.17.473248 January 13, 2022.
- Willett, B.J., Grove, J., MacLean, O.A. et al.: The hyper-transmissible SARS-CoV-2 Omicron variant exhibits significant antigenic change, vaccine escape and a switch in cell entry mechanism. medRxiv, preprint doi: https://doi.org/10.1101/2022.01.03.21268111, January 3, 2022.
- Chan, M.C.W. Hui, K.P., Ho, J. et al. : SARS-CoV-2 Omicron variant replication in human respiratory tract ex vivo. Research Square, December 22, 2021. https://doi.org/10.21203/rs.3.rs-1189219/v1
- Kozlov, M.: Omicron’s feeble attack on the lungs could make it less dangerous. Nature, 601, 177, 2022. doi: https://doi.org/10.1038/d41586-022-00007-8
- Halfmann, P.J., Ida, S., Iwatsuki-Horimoto, K. et al.: SARS-CoV-2 Omicron virus causes attenuated disease in mice and hamsters. Nature, 21 January 2022. https://doi.org/10.1038/s41586-022-04441-6
- Braga, L., Ali, H., Secco, I. et al.: Drugs that inhibit TMEM16 proteins SARS-CoV-2 spike-induced syncytia. Nature, 594, 3 June 2021. https://doi.org/10.1038/s41586-021-03491-6
- Le Page, M.: Why is omicron more infectious but less severe? What we know so far. New Scientist, 3369. 15 January 2022.
- Ahmed, S.F., Quadeer, A.A. & McKay, M.R.: SARS-CoV-2 T cell responses elicited Viruses, 14, 79, 2022. https://doi.org/10.3390/v14010079
- Lie, J., Chandraschekar, A., Sellers, D. et al.: Vaccines elicit highly conserved cellular immunity to SARS-CoV-2 Omicron. Nature, 31 January 2022.https://doi.org/10.1038/s41586-022-04465-y
- Viana, R., Moyo, S., Amoako, D.G. et al.: Rapid epidemic expansion of the SARS-CoV-2 Omicron variant in southern Africa. Nature, 7 January 2022. https://doi.org/10.1038/s41586-022-04411-y
- Mallapaty, S.: Where did Omicron come from? Nature, 602, 26-28, 2022. doi : https://doi.org/10.1038/d41586-022-00215-2.